近年来,再生医学已成为治疗各种疾病的有前途的选择。干细胞因其抑制炎症或细胞凋亡、细胞募集、刺激血管生成和分化等独特性质,被视为再生医学的良好候选者。随着再生医学市场的发展,越来越多的政府机构、企业和研究机构等涉足其中,进一步推动干细胞疗法的未来发展。
根据最新综述,近30年来,发表的干细胞疗法相关研究论文超过40183篇,已有超过6500项在线注册的干细胞临床项目,受益者达19万以上。干细胞疗法正在从理论走向临床实践。尽管医学取得了巨大进展,但仍有各种疾病无法得到有效治疗。因此,研究人员正在探索新的治疗方法,旨在不仅控制症状,还能治愈目前无法治疗的疾病。

再生医学被视为现代科学中治疗无法治愈疾病的新希望。自干细胞及其独特性质被发现以来,它们被定义为器官和组织修复的治疗剂,广泛认为是再生医学的良好候选者。干细胞具有建立和恢复体内每个组织/器官的潜力,这是由其独特的增殖、分化和自我更新能力所决定。通过再生受损细胞,干细胞可帮助器官恢复,从而改善身体发育。
01干细胞疗法的发展历程:从理论到临床实践
在神秘的实验室里,研究人员们正忙碌着进行干细胞的再生医学治疗评估。他们深知,在进行这项治疗之前,必须对干细胞进行评估。因为他们需要选择目标疾病并确保了解引起疾病的机制,这是治疗成功的关键。疾病相关机制是指引起特定疾病的细胞和分子过程,只有了解了这些机制,才能有效地改善疾病引起的破坏,最终恢复有缺陷的组织。
为了确定干细胞治疗的潜力,研究人员进行了临床前研究,并在目标疾病的动物模型中评估最终产品的安全性。他们选择使用啮齿动物进行体内研究,因为体内研究的优势在于它们可以补充体外研究的局限性,并且可以通过使用类似人类的生物环境在人类中推断其应用的结果。为了建立干细胞疗法的体内实验,他们根据要评估的具体安全性方面选择最相关的动物模型。
在可能的情况下,研究人员使用为人类制造的细胞衍生药物进行概念验证和安全性研究,以确保治疗的效果是正面的。在进行临床前研究时,他们必须考虑几个因素,包括细胞类型测定、细胞剂量规格、给药途径以及安全性和效率。如果有任何负面影响,研究人员必须在每个步骤检查安全可能性。
在对人类(即患者)进行治疗之前,临床前研究必须包括检查治疗效果是正面还是负面。如果研究人员发现任何负面影响,他们必须在每个步骤检查安全可能性。只有在临床前研究足够的情况下,才能将其转化为临床试验,并向所在地的监管部门比如美国食品和药物管理局(FDA),欧洲药品管理局(EMA)等进行提交申请。
02全球现状:超过6500项干细胞临床注册
在世界各地,干细胞研究正如一场迷人的探险。数以千计的项目在clinicaltrials.gov系统上注册,其中有超过6500项涉及人体试验。
招募状况:数据显示,在这些注册临床项目中,18%正在进行招募,42%已完成招募(图1)。
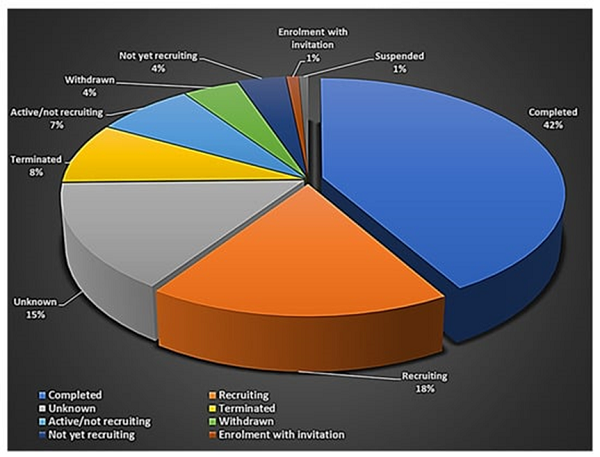
图1:使用干细胞的临床试验现状。
疾病类型:血液和淋巴疾病是最常见的治疗对象,因为干细胞可以产生造血干细胞(图2)。此外,间充质干细胞也被用于多种疾病的临床试验研究(图2)。
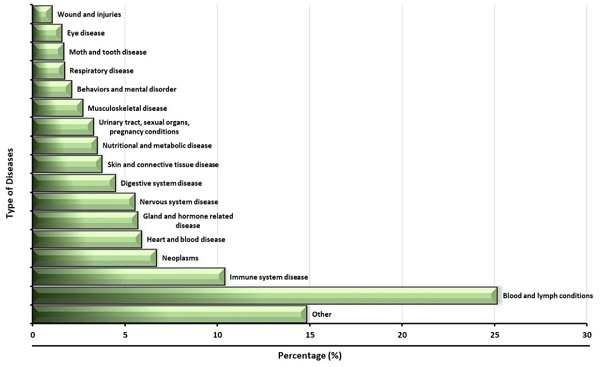
图2:在使用干细胞的临床试验中考虑的疾病。
自体与异体:干细胞产品可分为两类:自体和异体干细胞。自体干细胞是从患者体内收集的,而同种异体干细胞则是从健康供体收集的。不同的干细胞类型需要不同的先决条件测试来确保其安全性。在临床试验研究中,同种异体干细胞与自体干细胞使用比例为46.34%:44.51%。,如图3。
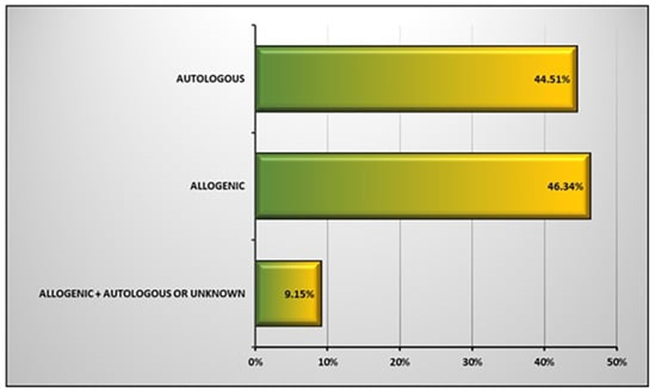
图3:在使用干细胞的临床试验中应用干细胞类型。
临床阶段:在医学领域,临床试验是一项极为重要的研究,其分为不同的阶段。每个阶段都有着不同的目的,参与者人数和随访时间也会有所不同。只有在主管部门已经审查了完成该阶段的结果之后,才能够开始新的临床试验阶段。因此,在每个阶段结束时,主管部门都需要对新药是否安全有效地治疗目标疾病进行评估。据数据显示(图4),在已注册的临床项目中,有16.3%的项目属于I期临床试验,而35.92%则属于II期临床试验。
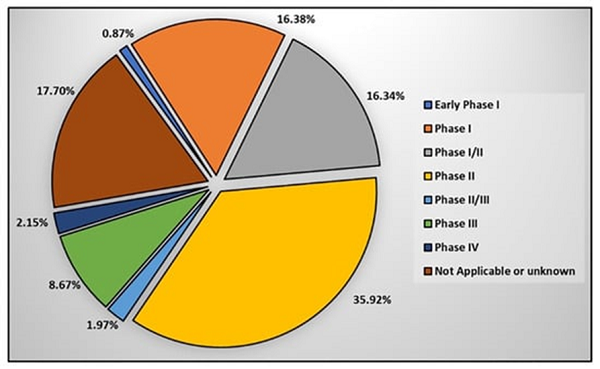
图4:使用干细胞的临床试验中临床阶段的状态。
参与者的数量和持续时间:针对干细胞产品而言,在成功完成临床试验阶段之后,才能够投入市场进行更广泛使用。每个研究和阶段的参与者人数以及长期随访的持续时间都是不同的(如图5和图6所示)。参与临床试验研究每个阶段的志愿者人数也各不相同,因为每个阶段都有其独特的目标。
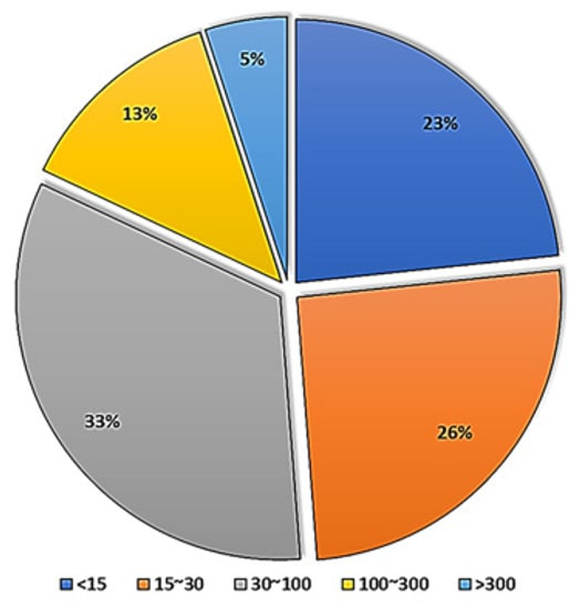
图5:使用干细胞注册临床试验。
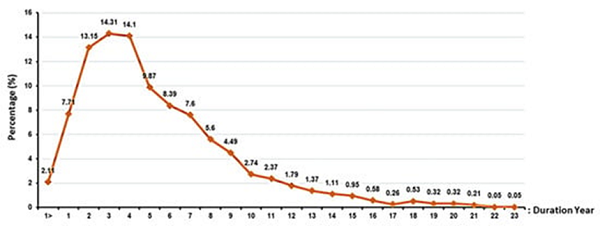
图6:每个使用干细胞的临床试验研究的持续时间。
根据FDA的建议,I期、II期和III期临床试验的参与者应分别为20-80、100-300和数百至数千人。虽然FDA已经确定了每个阶段的范围,但参与者的数量可能因疾病类型而异。一般情况下,罕见疾病临床研究的参与者人数将低于研究常见疾病时的参与者人数。
参与者的年龄:目前,约有190,000人参加了所有已完成注册的干细胞临床试验研究。每项临床研究都是在不同年龄组进行的,并且根据药物类型、疾病类型以及赞助商的决定,各研究之间也会存在差异。(图7)
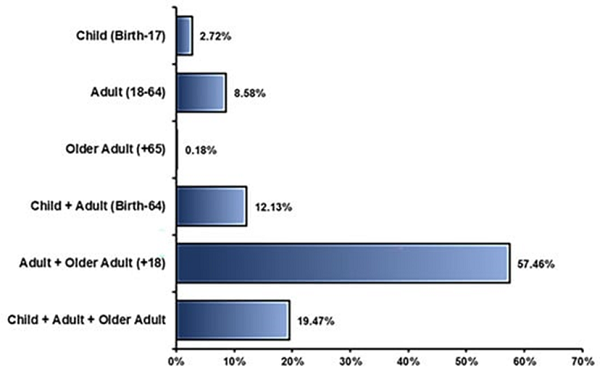
图7:参与使用干细胞的临床试验的患者年龄。
临床试验研究数量:从2000年至2014年,临床试验研究数量逐渐增加,尽管在2014年之后有所波动,但并没有出现显著变化(图8)。至于为什么在2014年有了这一增长,目前还不得而知,但可能与EMA在2014-2015年期间推出了第一个含有干细胞(Holoclar)的先进药物治疗产品有关[11]。
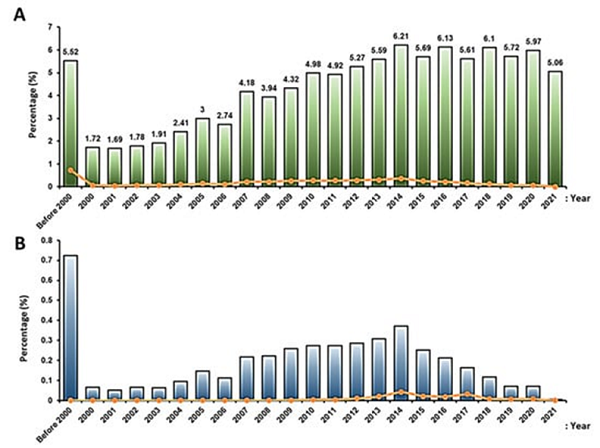
图8:每年使用干细胞的临床试验比例:(A)每年使用干细胞的新临床试验研究比例(绿色条)和相应的注册结果比例(橙色线);(B) 按年份使用干细胞完成的注册临床试验研究的比例(蓝色条)和按年份使用干细胞完成的临床试验研究的最新结果(橙色线)。
研究分布:根据clinicaltrial.gov的数据显示,干细胞临床试验分布前三的是美国、中国、法国(图9)
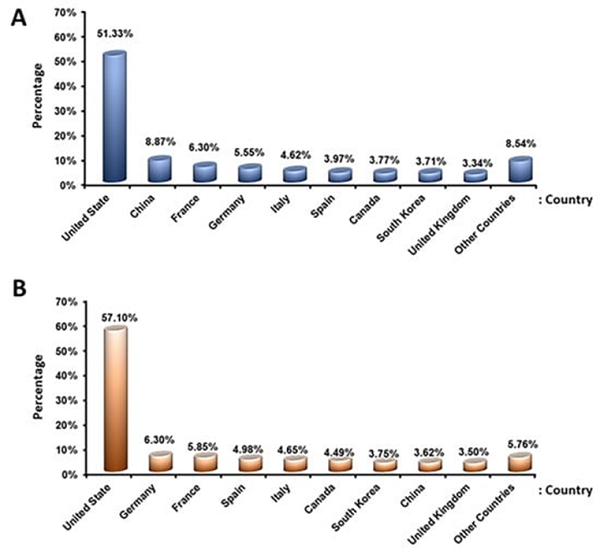
图9:(A)使用干细胞进行注册临床试验的前10个参与国;(B)已完成干细胞注册临床试验前10个国家。
(细胞科普)

